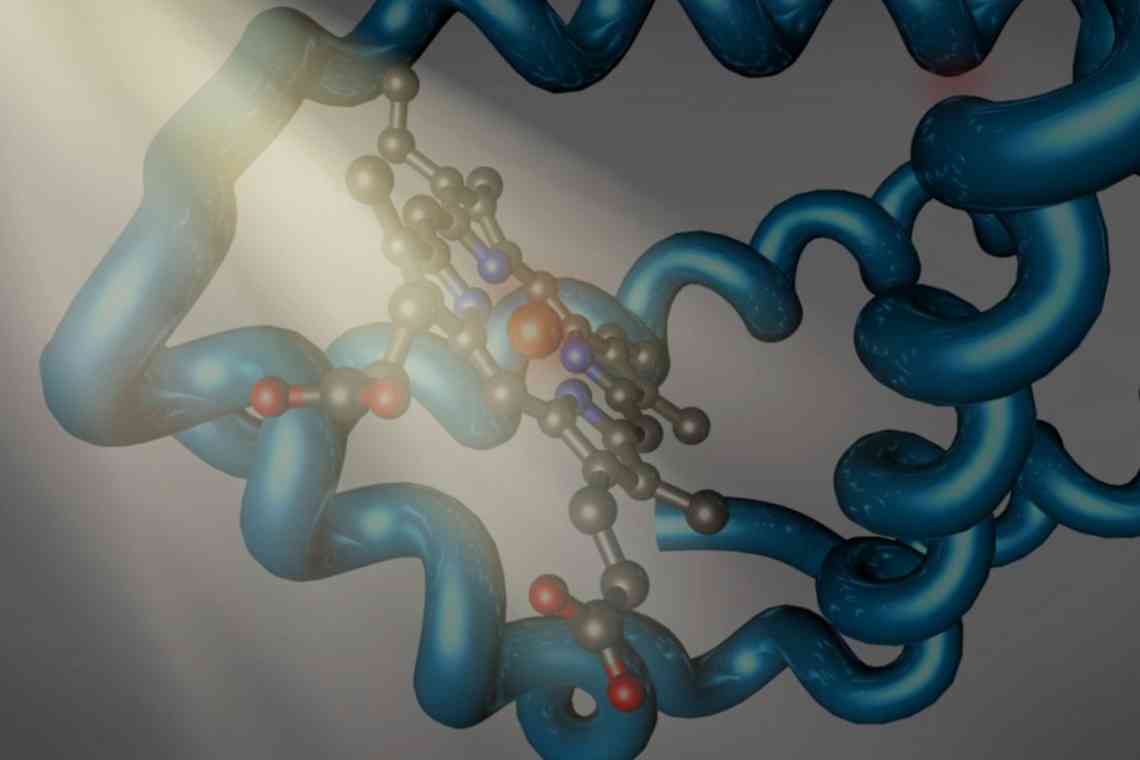
У кожній живій клітині відбувається багато хімічних реакцій. Ферменти (ензими) - білки з особливими і вкрай важливими функціями. Їх називають біокаталізаторами. Основна функція білків-ферментів в організмі полягає в прискоренні біохімічних реакцій. Вихідні реагенти, взаємодія яких каталізується цими молекулами, іменуються субстратами, а кінцеві сполуки - продуктами.
У природі білки-ферменти працюють тільки в живих системах. Але в сучасній біотехнології, клінічній діагностиці, фармацевтиці та медицині застосовуються очищені ензими або їх комплекси, а також додаткові компоненти, необхідні для роботи системи і візуалізації даних для дослідника.
Біологічне значення та властивості ферментів
Без цих молекул живий організм не зміг би функціонувати. Всі процеси життєдіяльності злагоджено працюють завдяки ензимам. Головна функція білків-ферментів в організмі - регулювання обміну речовин. Без них неможливий нормальний метаболізм. Регуляція активності молекул відбувається під дією активаторів (індукторів) або інгібіторів. Контроль діє на різних рівнях синтезу білків. Він також «працює» щодо вже готової молекули.
Основна властивість білків-ферментів - специфічність до певного субстрату. І, відповідно, здатність каталізувати тільки одну або рідше ряд реакцій. Зазвичай подібні процеси обратими. За виконання обох функцій відповідальний один фермент. Але це ще не все.
Роль білків-ферментів істотна. Без них не протікають біохімічні реакції. За рахунок дії ферментів з'являється можливість реагентам подолати активаційний бар'єр без істотних витрат енергії. В організмі немає можливості нагріти температуру понад 100 ° С або використовувати агресивні компоненти на зразок хімічної лабораторії. Білок-фермент з'єднується з субстратом. У пов'язаному стані відбувається модифікація з подальшим звільненням останнього. Саме так діють всі каталізатори, що застосовуються в хімічному синтезі.
Які рівні організації молекули білка-ферменту?
Зазвичай ці молекули мають третинну (глобула) або четвертичну (декілька сполучених глобул) білкову структуру. Спочатку вони синтезуються в лінійному вигляді. А потім згортаються в необхідну структуру. Для забезпечення активності біокаталізатору необхідна певна будова.
Ферменти, як і інші білки, руйнуються при нагріванні, екстремальних значеннях pH, агресивних хімічних сполук.
Додаткові властивості ферментів
Серед них виділяють такі особливості компонентів:
- Стереоспецифічність - освіта тільки одного продукту.
- Регіоселективність - розрив хімічного зв'язку або модифікація групи тільки в одному положенні.
- Хемоселективність - каталіз тільки однієї реакції.
Особливості роботи
Рівень специфічності ферментів варіюється. Але будь-який ензим завжди активний щодо конкретного субстрату або групи з'єднань, аналогічних за структурою. Небілкові каталізатори не мають такої властивості. Специфічність вимірюється константою зв'язування (моль/л), яка може досягати 10 ‑ 10 моль/л. Робота активного ферменту стрімка. Одна молекула каталізує тисячі-мільйони операцій на секунду. Ступінь прискорення біохімічних реакцій істотно (в 1000-100000 разів) вище, ніж у звичайних каталізаторів.
Дія ферментів побудована на декількох механізмах. Найбільш проста взаємодія відбувається з однією молекулою субстрату з подальшим утворенням продукту. Більшість ензимів здатні пов'язувати 2-3 різні молекули, що вступають в реакцію. Наприклад, перенесення групи або атома від одного з'єднання до іншого або подвійне заміщення за принципом «пінг-понг». У цих реакціях зазвичай з'єднується один субстрат, а другий зв'язується за допомогою функціональної групи з ферментом.
Вивчення механізму дії ферменту відбувається за допомогою методів:
- Визначення проміжних та кінцевих продуктів.
- Вивчення геометрії структури і функціональних груп, що пов'язуються з субстратом і забезпечують високу швидкість реакції.
- Мутації генів ферменту і визначення зміни в його синтезі та активності.
Активний і зв'язувальний центр
Молекула субстрату значно менша за розміром, ніж білок-фермент. Тому зв'язування відбувається за рахунок невеликого числа функціональних груп біокаталізатора. Вони формують активний центр, що складається з певного набору амінокислот. У складних білках у структурі присутня простетична група небілкової природи, яка також може входити до складу активного центру.
Слід виділити окрему групу ензимів. У них до складу молекули входить кофермент, що постійно зв'язується з молекулою і звільняється від неї. Повністю сформований білок-фермент називається холоферментом, а при видаленні кофактора - апоферментом. Як коферменти часто виступають вітаміни, метали, похідні азотистих підстав (НАД - нікотинамідаденінклеотид, ФАД - флавінаденіндінуклеотид, ФМН - флавінмононуклеотид).
Зв'язуючий центр забезпечує специфічність споріднення до субстрату. За рахунок нього формується стійкий субстратно-ферментний комплекс. Структура глобули побудована так, щоб мати на поверхні нішу (щілину або западину) певного розміру, що забезпечує зв'язування субстрату. Розташовується ця зона зазвичай недалеко від активного центру. Окремі ферменти мають ділянки для з'єднання з кофакторами або іонами металів.
Ув'язнення
Білок-фермент відіграє важливу роль в організмі. Подібні речовини каталізують хімічні реакції, відповідають за процес обміну речовин - метаболізм. У будь-якій живій клітині постійно відбувається сотні біохімічних процесів, що включають відновлювальні реакції, розщеплення і синтез сполук. Постійно відбувається окислення речовин з великим виділенням енергії. Вона в свою чергу витрачається на формування вуглеводів, білків, жирів та їх комплексів. Продукти розщеплення є структурними елементами для синтезу необхідних органічних сполук.